长期以来,血管紧张素系统(Renin–Angiotensin System,RAS)被视为调节血压和水盐平衡的重要外周系统。然而,1971年Ganten等人的研究发现,在特定脑区内也存在肾素和血管紧张素原的合成,从而提出了中枢RAS的概念。尽管外周和中枢RAS之间的相互作用尚未完全明确,但大量后续研究表明,它们具有不同功能:外周RAS主要维持心血管和肾脏稳态,而大脑RAS则成为认知和情绪的重要调控器,包括奖赏与动机、学习与记忆,以及应激与恐惧反应,并且参与抑郁症、PTSD和AD等多种神经精神疾病的病理发展过程。
基于此,心理学部许婷副教授联合北京协和医学院基础医学院马超教授、电子科技大学生命科学与技术学院尧德中教授及香港大学心理学系Benjamin Becker教授在Cell旗下权威期刊《Trends in Molecular Medicine》(IF = 13.8,中科院升级版大类医学1区TOP,图1)发表了题为《Renin-Angiotensin System: a Novel Target for Brain Health》的综述。文章系统阐述了中枢RAS在调控奖赏加工、应激和记忆等关键认知和情绪过程中的核心作用(前期工作详寻:Xu, T., … Becker, B*. Biological Psychiatry-Cognitive Neuroscience and Neuroimaging, 2022; Zhou, X., Xu, T., … Becker, B*. Journal of Neuroscience, 2023; Xu, T., … Becker, B*. Molecular Psychiatry, 2023; Xu, T., … Becker, B*. Proceedings of the National Academy of Sciences of the United States of America, 2024),及其在抑郁症、创伤后应激障碍(PTSD)和阿尔茨海默病(AD)等多种神经精神疾病中的跨诊断治疗潜力,并进一步指出靶向该系统的现有药物—血管紧张素Ⅱ 1型受体阻断剂(ARBs),有望成为改善这些疾病核心症状的新型精准治疗方案。

图1. 论文信息
该综述指出,中枢RAS发挥调控作用的核心在于其受体间的动态平衡。其中,血管紧张素II 1型受体(AT1R)过度激活会触发氧化应激、神经炎症和突触功能障碍,最终导致神经元凋亡,构成“神经毒性”轴。相反,血管紧张素II 2型受体(AT2R)、4型受体(AT4R)及MAS受体(MasR)则构成“神经保护”轴,通过促进神经发生、增强突触可塑性、抑制炎症反应和维护脑血管健康来对抗前述损害(图2)。
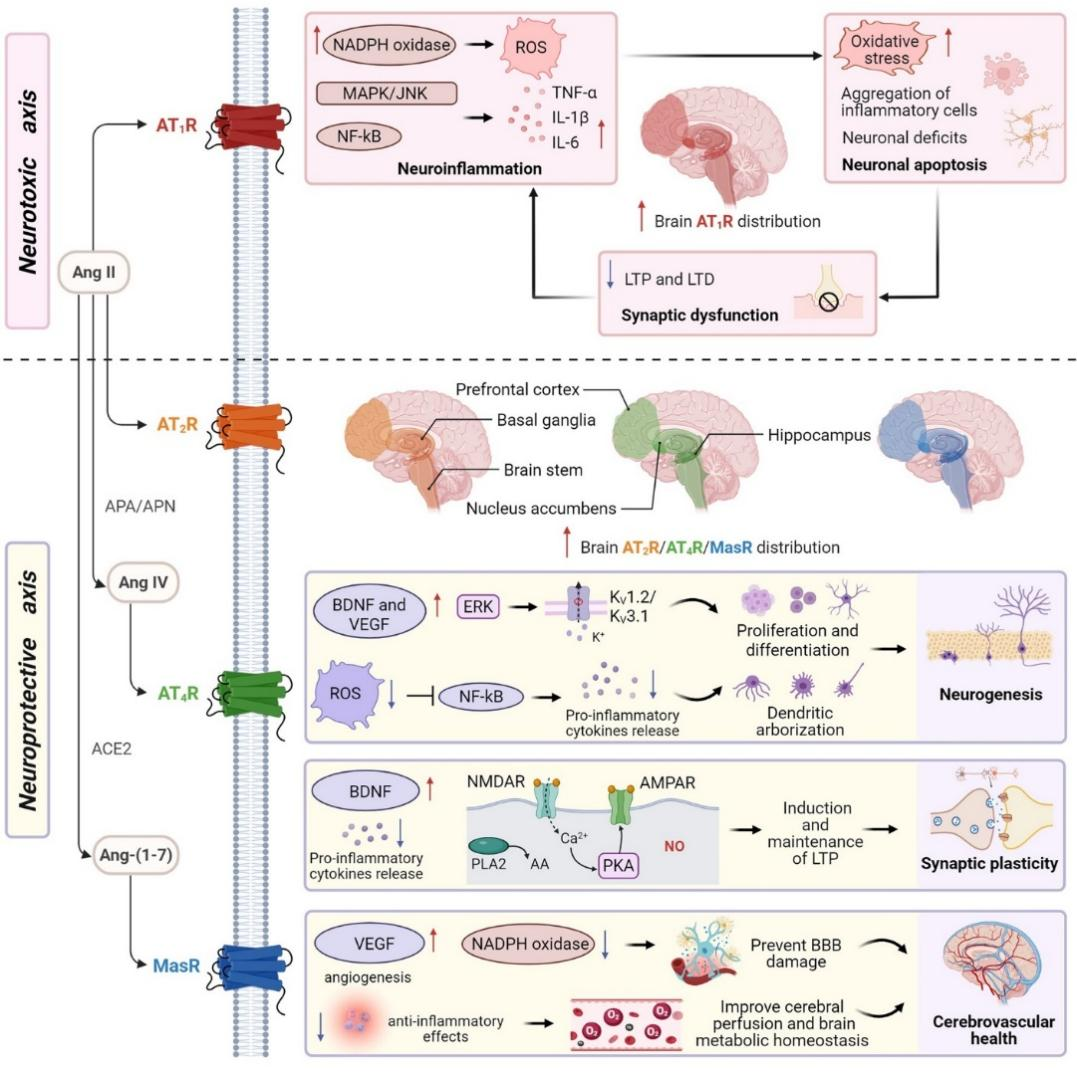
图2. 中枢RAS受体分布及其作用的分子机制
基于此机制,临床上广泛用于降压的ARBs(如氯沙坦、坎地沙坦等)因其能高选择性阻断AT1R,同时可能保留甚至增强神经保护轴信号,而成为极具潜力的脑功能调节剂。现有神经药理学调控研究显示,ARBs能特异性调节三大核心脑网络发挥多维度调控作用(见图3):一方面,通过作用于前额叶-纹状体回路,增强对积极反馈的敏感性,同时抑制对负性信息的过度学习,从而显现出改善抑郁症患者快感缺失相关症状的潜力;另一方面,通过保护海马体-前额叶网络的结构与功能完整性,提升记忆编码与辨别能力,对抗AD中的认知衰退;此外,通过调节前额叶-边缘系统(如杏仁核和海马体)的连接,促进恐惧记忆的消退,这对于PTSD的治疗尤为关键。
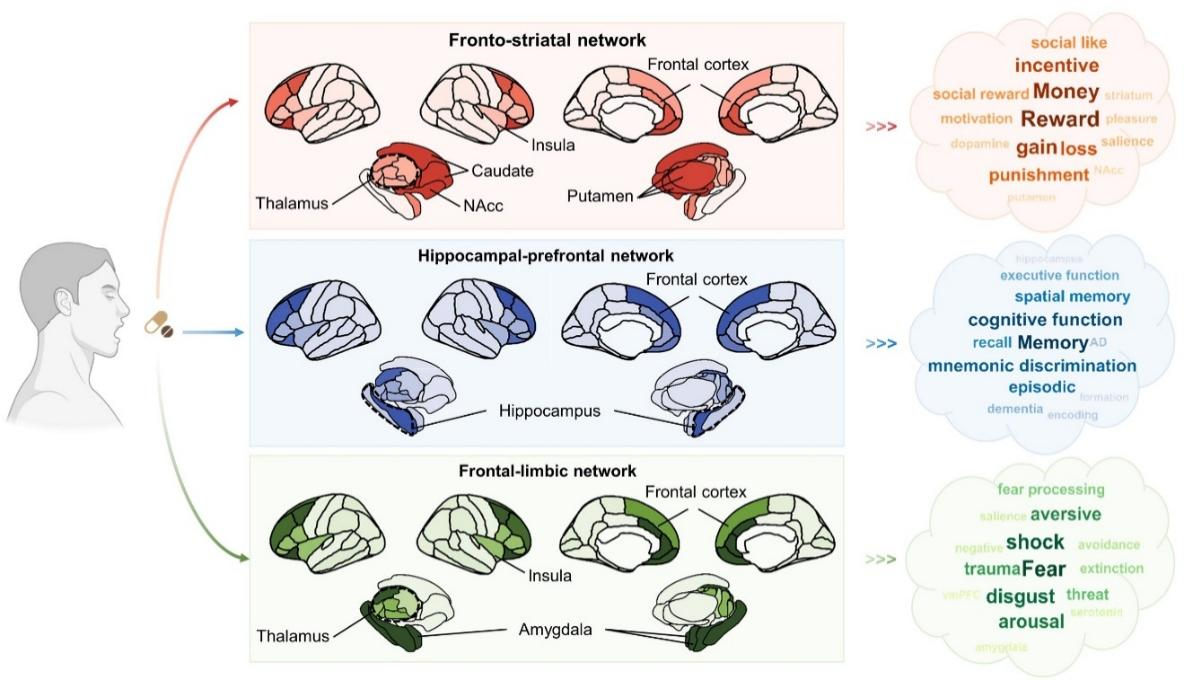
图3. 阻断中枢AT1R可作用特定脑回路以调节奖赏动机、记忆形成及恐惧加工
在治疗潜力方面,该综述汇总证据表明,ARBs不仅通过其强大的抗神经炎症作用发挥效益,还可能调节多巴胺等神经递质系统,并稳定下丘脑-垂体-肾上腺(HPA)轴功能。与此机制相呼应,多项大队列观察研究和临床初步试验发现,ARBs的使用与痴呆发病风险下降、抑郁症状缓解以及PTSD严重程度减轻显著相关(见图4)。
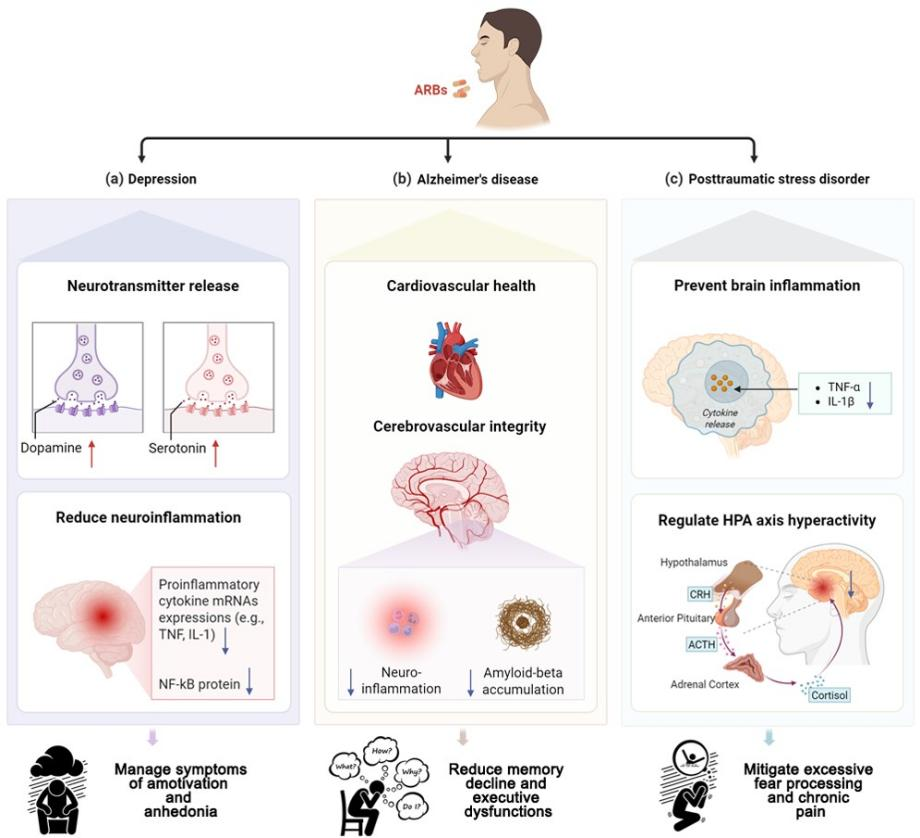
图4. ARBs在抑郁症、阿尔茨海默病及创伤后应激障碍中的治疗潜力
最后,该综述也指出目前研究结果并不完全一致,这可能与患者异质性(如高血压、糖尿病等共病情况)、给药方案(剂量与疗程)的差异、性别特异性反应以及临床结果指标选择不同等因素有关。基于此,未来研究亟需开展“精准临床试验”,在试验设计中引入神经影像学、炎症生物标志物及药代动力学分层分析,以识别最可能获益的患者亚群。同时,探索ARBs与行为干预(如针对PTSD的暴露疗法、针对AD的认知训练)相结合的多模态治疗策略,有望实现协同效应,进一步提升疗效。值得注意的是,针对这些关键科学问题,研究团队已在精神障碍患者中启动初步临床试验,为未来验证中枢RAS干预的可行性与转化潜力奠定基础。
该工作得到科技创新2030—“脑科学与类脑研究”重大项目(2022ZD0208500)、国家自然科学基金(32250610208,82271583,32500964),香港健康与医学研究基金(23243971)以及西南大学中央高校基本科研业务费(SWU2509744)的资助与支持。
论文来源:
Xu, T*., Fu, K., Ma, C., Yao, D., & Becker, B*. (2025). Renin–angiotensin system: a novel target for brain health. Trends in Molecular Medicine.
前期工作基础:
Xu, T., Chen, Z., Zhou, X., Wang, L., ... & Becker, B*. (2024). The central renin angiotensin system-a genetic pathway, functional decoding and selective target engagement characterization in humans. Proceedings of the National Academy of Sciences of the United States of America, 121(8).
Xu, T., Zhou, X., Kanen, J. W., Wang, L., … & Becker, B. (2023). Angiotensin blockade enhances motivational reward learning via enhancing striatal prediction error signaling and frontostriatal communication. Molecular psychiatry, 28(4), 1692–1702.
Zhou, X., Xu, T., Zeng, Y., Zhang, R., Qi, Z., Zhao, W., ... & Becker, B*. (2023). The angiotensin antagonist Losartan modulates social reward motivation and punishment sensitivity via modulating midbrain-striatofrontal circuits. Journal of Neuroscience, 43(3), 472-483.
Xu, T., Zhou, X., Jiao, G., Zeng, Y., Zhao, W., Li, J., ... & Becker, B*. (2022). Angiotensin antagonist inhibits preferential negative memory encoding via decreasing hippocampus activation and its coupling with the amygdala. Biological Psychiatry-Cognitive Neuroscience and Neuroimaging, 7(10), 970-978.





