注意缺陷多动障碍(Attention deficit hyperactivity disorder,ADHD)是儿童青少 年时期最常见的神经发育障碍之一,全球范围内患病率约为7.2%,我国儿童发病率为6.3%,其核心症状是注意力不集中、多动和冲动,约 65%的 ADHD 患儿部分或全部症状将持续到成年期,发展为成人 ADHD。ADHD 与一系列认知功能缺陷有关,如行为抑制、工作记忆、计划和组织、决策等,并常与孤独症谱系障碍、阅读障碍、智力障碍等神经发育障碍共病。此外,ADHD 患者药物滥用、意外伤害、犯罪、职业失败、离婚、自杀和过早死亡等多种不良结局的发生率显著高于健康人群,给个人、家庭和社会带来极大负担,已成为危害我国儿童和青少年身心健康的重要公共卫生问题。因此,深入探讨ADHD发病相关神经影像和分子标志物,对于 ADHD 高危个体的筛查及个体化防治具有重要的科学意义和现实价值。迄今为止,ADHD 的病因复杂,发病机制尚不完全明确,其可能的假说涵盖遗传学、代谢组学、免疫学、神经生物学等多方面,但当前的研究很少阐明ADHD在分子水平、脑连接和功能共同表征的不一致性。
为此,冯廷勇教授团队结合脑影像-基因表达的多模态跨尺度数据,确定了ADHD 脑网络梯度紊乱的特异性神经影像表型特征(Imaging-derived phenotypes, IDPs),并通过宏观神经影像-基因转录关联的分析方法揭示了IDPS的转录组标记物;同时,利用基于图像的元认知解码分析方法将上述转录组标记解码为与认知、神经、神经病学和神经精神疾病相关的风险基因集;最后,通过并行富集分析,揭示了与IDPs相关的细胞类群和通路,有助于全面了解ADHD的病理生理基础(图1)。
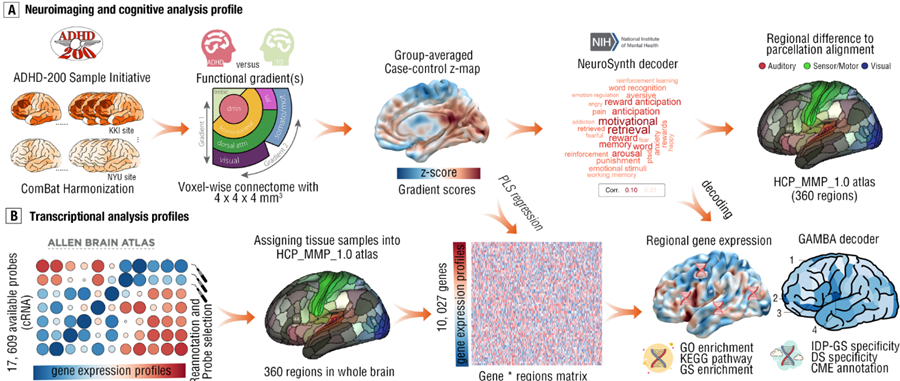
图 1 研究思路
近日,西南大学心理学部冯廷勇教授团队在国际著名学术期刊《Psychiatry and Clinical Neurosciences》(JCR SCI一区,IF=11.90)发表上题为“Cortical gradient perturbation in attention deficit hyperactivity disorder correlates with neurotransmitter-, cell type-specific and chromosome- transcriptomic signatures”的学术论文。研究团队首先通过脑网络连接梯度分析和使用ADHD-200公开临床数据集,揭示了ADHD患者的大尺度脑网络连接梯度的紊乱,主要体现为基本视觉或感觉处理以及涉及高级认知和调节过程的跨模态节点相关脑网络连接梯度的功能失调。基于艾伦人脑基因表达公开数据库,研究团队继而采用脑连接-转录组联合分析,揭示了ADHD连接梯度的异常模式与奖励、抑制控制和情绪监测等认知过程有功能相关,而围绕该异常连接梯度的PLS+和PLS-基因成分:(1)与GABAa/bz和5-HT2A神经递质表达密度呈显著正相关;(2)具备与孤独症谱系障碍、阅读障碍和创伤后应激障碍等神经发育或精神障碍同样的风险转录标志;(3) 主要富集在分泌、趋化作用和突触囊泡循环的生物学过程;(4)其中PLS+基因列表富含少突胶质前体细胞和内皮细胞,并在染色体18、21和X上过度表达。因此,本研究从ADHD宏观神经影像标志(脑网络连接梯度紊乱)和微观分子机制(基因、细胞特异性和染色体变异)层面为理解ADHD脑网络受损病理机制提供了新的角度,并为建立适用的ADHD临床疗效评估的神经生理标志物提供了重要的参考。
论文的第一作者为西南大学心理学部毕业博士研究生陈志毅(现陆军军医大学医学心理系特聘教授),共同第一作者为西南大学心理学部毕业硕士研究生许婷(现电子科技大学在读博士),西南大学心理学部冯廷勇教授为通讯作者。该研究得到国家重点研发计划(2022YFC2705201)、中国人民解放军人才计划基金(2022160258、202211001)和国家自然科学基金(32300907)的资助。
论文索引:
Chen, Z., Xu, T., Liu, X., Becker, B., Li, W., Xia, L., ... & Feng, T. (2024). Cortical gradient perturbation in attention deficit hyperactivity disorder correlates with neurotransmitter‐, cell type‐specific and chromosome‐transcriptomic signatures. Psychiatry and Clinical Neurosciences. https://onlinelibrary.wiley.com/doi/abs/10.1111/pcn.13649.
原文摘要:
Aims: This study aimed to illuminate the neuropathological landscape of attention deficit hyperactivity disorder (ADHD) by a multiscale macro–micro-molecular perspective from in vivo neuroimaging data.
Methods: The “ADHD-200 initiative” repository provided multi-site high-quality resting-state functional connectivity (rsfc-) neuroimaging for ADHD children and matched typically developing (TD) cohort. Diffusion mapping embedding model to derive the functional connectome gradient detecting biologically plausible neural pattern was built, and the multivariate partial least square method to uncover the enrichment of neurotransmitomic, cellular and chromosomal gradient-transcriptional signatures of AHBA enrichment and meta-analytic decoding.
Results: Compared to TD, ADHD children presented connectopic cortical gradient perturbations in almost all the cognition-involved brain macroscale networks (all pBH <0.01) and co-varied with genetic transcriptional expressions (e.g. DYDC2, ATOH7, all pBH <0.01), associated with phenotypic variants in episodic memory and emotional regulations. Enrichment models demonstrated such gradient-transcriptional variants indicated the risk of both cell-specific and chromosome- dysfunctions, especially in enriched expression of oligodendrocyte precursors andendothelial cells (all pperm <0.05) as well enrichment into chromosome 18, 19 and X (pperm <0.05).
Conclusions: Our findings bridged brain macroscale neuropathological patterns to microscale/cellular biological architectures for ADHD children, demonstrating the neurobiologically pathological mechanism of ADHD into the genetic and molecular variants in GABA and 5-HT systems as well brain-derived enrichment of specific cellular/ chromosomal expressions.





